Лейкозы у детей: симптомы, диагностика, лечение
Лейкозы относятся к большой группе злокачественных новообразований системы крови под названием «гемобластозы». Лейкоз (от греческого слова «leukos» — белый) — злокачественная опухоль, возникающая из ранних незрелых кроветворных клеток костного мозга и метастазирующая из костного мозга в кровь, лимфатические узлы, печень, селезенку, головной мозг, спинной мозг и другие органы и ткани.
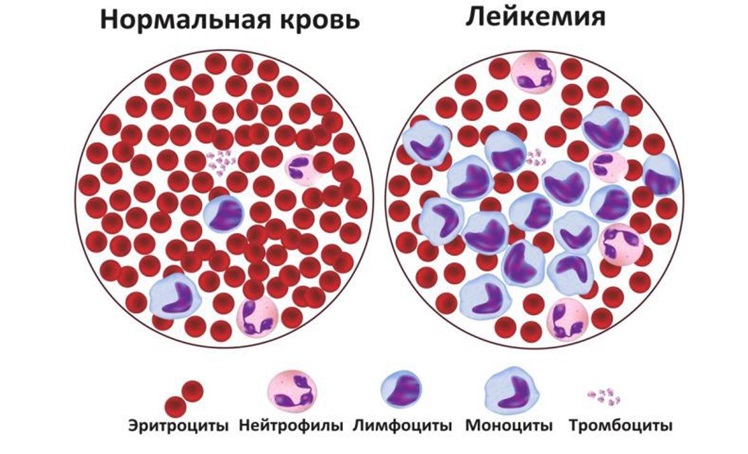
Все лейкозы можно разделить на острые лимфобластые, острые миелоидные лейкозы (ОМЛ) и хронический миелолейкоз.
Острый лимфобластный лейкоз
Более 80% всех лейкозов у детей составляет острый лимфобластный лейкоз (ОЛЛ). Причиной его развития является химерный ген TEL/AML, формирование которого происходит внутриутробно, возможно, в результате спонтанных ошибок в процессе репликации и репарации ДНК. Накопление генетических аномалий в опухолевом клоне ведет к блоку нормальной клеточной дифференцировки и нарушениям в процессе пролиферации и апоптоза.
В соответствии с франко-американо-британской (FAB) классификацией выделяют три морфологических варианта: L1, L2, L3.
Клинические симптомы ОЛЛ обусловлены степенью инфильтрации костного мозга лимфобластами, а также наличием экстрамедуллярного распространения процесса. Нередко отмечаются общие симптомы опухолевой интоксикации, а именно, повышение температуры тела, снижение аппетита, слабость, вялость. В течение процесса выделяют несколько периодов: начальный, развернутый, период ремиссии.
Развернутый период характеризуется бурным началом, многообразием клинических симптомов. К симптомам общей интоксикации присоединяются костные боли вследствие лейкозной инфильтрацией костной ткани (чаще поражаются диафизы длинных трубчатых костей), артралгии, вызванные лейкемической инфильтрацией суставов. Кожные покровы и слизистые становятся бледными. К сожалению, нередко на них появляются кровоизлияния, обусловленные геморрагическим синдромом, а также кровотечения (носовые, желудочно-кишечные, почечные). Увеличение периферических лимфатических узлов (шейно-надключичных, подмышечных, паховых) является одним из основных симптомов заболевания. Практически у всех пациентов отмечается обусловленное пролиферацией лейкозных клеток увеличение печени и селезенки. В некоторых случаях у пациентов поражение кожи и слизистых оболочек проявляется в виде лейкемидов, некроза, гингивита и стоматита.
Таким образом, можно выделить несколько симптомокомплексов, характерных для ОЛЛ:
- гиперпластический – лимфоаденопатия, боли в костях, тяжесть и боли в левом и правом подреберьях, гепатоспленомегалия;
- анемический – головокружение, мерцание мушек перед глазами, одышка при физической нагрузке, сердцебиение, шум в голове и ушах;
- геморрагический – кожные геморрагии, кровоточивость десен, носовые кровотечения;
- интоксикационный – повышение температуры тела, слабость, отсутствие аппетита, оссалгии;
- синдром инфекционных осложнений – присоединение тяжелых пневмоний.
При диагностике оцениваются морфологические особенности бластов костного мозга и периферической крови. Помимо обнаружения опухолевых клеток лимфоидной линии кроветворения при окраске по Романовскому – Гимзе, проводятся следующие методы исследования:
- цитохимические – позволяют отнести бласты к лимфоидному или миелоидному ростку (тест на миелопероксидазу, фосфолипиды, гликоген), отдельным клеточным линиям;
- иммунофенотипические – определяют иммунные маркеры клеток (CD);
- цитогенетические – определяют аномалии кариотипа и хромосомные аберрации (делеции, транслокации, инверсии и др.);
- молекулярно-биологические – позволяют установить количество клеток с определенной аберрацией во всей массе костного мозга.
Для подтверждения диагноза ОЛЛ необходимо комплексное обследование, в котором ведущая роль отводится морфологическому методу.
В настоящее время используются программы лечения BFM (БФМ: Берлин-Франкфурт-Мюнстер) и МВ (МБ: Москва-Берлин).
Все лечение можно разделить на базисное и сопроводительное. Базисная терапия представляет собой системную и локальную химиотерапию и, при необходимости, лучевую терапию. Сопроводительное лечение обязательно назначается для профилактики инфекционных осложнений и коррекции постцитостатических реакций. Выделяют следующие этапы в лечении злокачественных процессов: индукция ремиссии, консолидация ремиссии (как правило, несколько фаз), поддерживающее лечение.
Острый миелоидный лейкоз
Острый миелоидный лейкоз составляет 15% всех острых лейкозов у детей. Существующая FAB-классификация (Франко-Американо-Британская) позволяет разделить ОМЛ на следующие варианты:
- M0 (минимально дифференцированный ОМЛ), который характеризуется бластными клетками средних размеров с округлым ядром, отсутствием зернистости и палочек Ауэра в цитоплазме;
- М1 (ОМЛ без созревания), при котором менее 90% неэритроидных клеток представлены бластными клетками с преобладающей мезогенераций с округлыми ядрами и высоким ядерно-цитоплазматическим отношением;
- М2 (ОМЛ с созреванием), характеризующийся бластными клетками средних размеров с высоким и умеренным ядерно-цитоплазматическим отношением (20 – 90% всех неэритроидных клеток), в их цитоплазме выражено наличие азурофильной зернистости и палочек Ауэра;
- М2 баз (базально-клеточный), бластные клетки характеризуются наличием базофильной зернистости, составляет не более 0,5% острых нелимфобластных лейкозов;
- М3 (промиелоцитарный) вариант характеризуется бластными клетками крупных размеров с ядрами неправильной формы, отмечается крупная зернистость и палочки Ауэра в цитоплазме;
- М3v (гипогранулярный) с отсутствием зернистости;
- М4 (миеломонобластный): бластные клетки с ядрами округлой и неправильной формы, низким и умеренным ядерно-цитоплазматическим отношением, некоторые бластные клетки могут содержать зернистость, палочки Ауэра;
- М5а (монобластный без созревания), при котором монобласты составляют свыше 80% моноцитоидных клеток, бластные клетки крупных размеров с ядрами бобовидной или лопастной формы, в части из них просматривается зернистость, палочки Ауэра при этом не выявляются;
- М5b (монобластный с созреванием): монобласты составляют менее 80% моноцитоидных клеток, крупные с ядрами моноцитоидной формы, цитоплазмой без зернистости, палочки Ауэра не выявляются;
- М6 (эритромиелоз): более 50% бластом в костном мозге представлены эритробластами;
- М7 (мегакариобластный) лейкоз, при котором бластные клетки полиморфны, с отростчатой базофильной цитоплазмой, какие-либо специфические морфоцитохимические признаки отсутствуют.
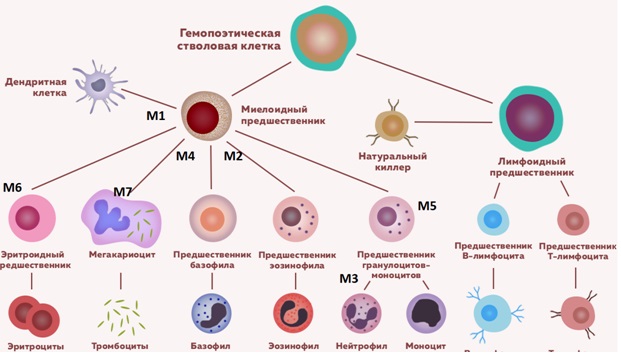
Схема гемопоэза с клетками предшественниками острого миелоидного лейкоза
Клиническая картина ОМЛ также складывается из анемического, геморрагического и токсического синдромов, которые являются следствием снижения продукции эритроцитов, тромбоцитов и гранулоцитов.
У 50% пациентов отмечается увеличение размеров печени (гепатомегалия) и селезенки (спленомегалия) вследствие инфильтрации органов опухолевыми клетками.
Внекостномозговые проявления заболевания связаны с лейкозной инфильтрацией центральной нервной системы и метастатическим поражением оболочек и вещества головного и спинного мозга (нейролейкемия). В этих ситуациях отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, могут быть нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, выявляются ригидность затылочных мышц, симптом Кернига.
Решающую роль в диагностике также имеет цитохимическое, иммунофенотипическое и морфологическое исследование бластов в костном мозге и периферической крови.
Ремиссию заболевания можно достичь посредством проведения высокодозной полихимиотерапии с последующей трансплантацией гемопоэтических стволовых клеток от HLA-геноидентичного родственного или альтернативного (неродственного, гаплоидентичного) донора у пациентов группы высокого риска рецидива. Благодаря адаптивным протоколам удается достичь ремиссии у 90% детей.
Хронические миелолейкоз
Хронический лейкоз – это вариант гемобластоза, субстратом которого являются созревающие клетки. У детей встречается только хронический миелолейкоз, который характеризуется пролиферацией гранулоцитарного ростка, гиперплазией миелоидной ткани, миелоидной метаплазией кроветворных органов, ассоциированной с хромосомной транслокацией t(9;22)(q34;q11), в результате которой образуется химерный онкоген BCR-ABL.
В течение хронического миелолейкоза выделяют три фазы:
- Хроническая фаза: выраженные симптомы отсутствуют.
- Фаза акселерации: повышение уровня лейкоцитов (>50 х 10 9 /л), бластов в периферической крови и костном мозге (> 10%); анемия и тромбоцитопения; персистирующий тромбоцитоз (> 1000 х 10 9 /л).
- Острая (бластная) фаза: миелобласты >30% в крови или в костном мозге; лимфобласты >30% в крови или в костном мозге; наличие бластных клеток в ликворе.
В дебюте заболевание трудно диагностировать, поскольку основные симптомы обусловлены общим опухолевым симптомокомплексом и носят преходящий характер. Наиболее частые симптомы, присоединяющиеся позднее – гепатомегалия и спленомегалия. Нарастающая интоксикация приводит к появлению слабости, утомляемости, повышению температуры тела, болям в костях.
В периферической крови отмечается гиперлейкоцитоз (до 200 – 300 х 10 9 /л и более) с увеличением содержания гранулоцитов до 95% и преобладанием незрелых клеток гранулоцитарного ряда: промиелоцитов, миелоцитов, метамиелоцитов, миелобластов, базофилов (до 10%) и эозинофилов (до 5%). Характерна анемия и повышение СОЭ. Уровень тромбоцитов преимущественно в норме, однако может отмечаться гипертромбоцитоз (до 600 х 10 9 /л и более).
В пунктате костного мозга отмечается увеличение числа миелокариоцитов за счет пролиферирующего пула клеток гранулоцитарного ряда с увеличением базофилов и эозинофилов. Позднее отмечается угнетение эритронормобластического и мегакариоцитарного ростков кроветворения.
Основным средством терапии и стандартом лечения хронического миелолейкоза в настоящее время является применение ингибиторов тирозинкиназы (ИТК). Данные препараты имеют механизм таргетного (целенаправленного) воздействия на BCR-ABL-положительные опухолевые клетки и должны назначаться всем пациентам после подтверждения диагноза. Для оценки эффективности и переносимости терапии ИТК рекомендуется регулярный мониторинг гематологических, цитогенетических и молекулярно-генетических и других показателей у пациента.
Список литературы
- Кузник Б. И. Клиническая гематология детского возраста: учеб. пособие / Б. И. Кузник, О. Г. Максимова. — М.: Вузовская книга, 2010. — 496 с.
- Румянцев А. Г. Практическое руководство по детским болезням. Т. 4. Гематология/онкология детского возраста / А. Г. Румянцев, Е. В. Самочатова. — М. : Медпрактика-М, 2004. — 792 c.
- Румянцев А.Г. Эволюция лечения острого лимфобластного лейкоза у детей. Педиатрия, 2016; 95(4): 11-22.
- Möricke A., Zimmermann M., Reiter A., et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia. 2010 Feb;24(2):265-84. doi: 10.1038/leu.2009.257.
- Creutzig U, van den Heuvel-Eibrink MM, Gibson B, et al. AML Committee of the International BFM Study Group. Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel. Blood. 2012 Oct 18;120(16):3187-205. doi: 10.1182/blood-2012-03-362608.
- de la Fuente J, Baruchel A, Biondi A, de Bont E, Dresse MF, Suttorp M, Millot F; International BFM Group (iBFM) Study Group Chronic Myeloid Leukaemia Committee. Managing children with chronic myeloid leukaemia (CML): recommendations for the management of CML in children and young people up to the age of 18 years. Br J Haematol. 2014 Oct;167(1):33-47. doi: 10.1111/bjh.12977.

Авторская публикация:
Кулева С.А.
Заведующая отделением, врач-детский онколог, ведущий научный сотрудник, профессор НМИЦ онкологии им. Н.Н. Петрова

Иванова Светлана Вячеславовна
Врач-детский онколог, научный сотрудник, кандидат наук НМИЦ онкологии им Н.Н. Петрова
Лейкоз у детей
Лейкоз у детей – злокачественное заболевание крови, характеризующееся опухолевой пролиферацией незрелых клеток-предшественников лейкоцитов. Клинические проявления лейкоза у детей могут включать увеличение лимфатических узлов, геморрагический синдром, боли в костях и суставах, гепатоспленомегалию, поражение ЦНС и др. Диагностике лейкоза у детей способствует развернутый общий анализ крови, проведение стернальной пункции с исследованием пунктата костного мозга. Лечение лейкоза у детей проводится в специализированных гематологических стационарах с помощью химиотерапии, иммунотерапии, заместительной терапии, трансплантации костного мозга.
- Причины лейкоза у детей
- Классификация лейкоза у детей
- Симптомы лейкоза у детей
- Диагностика лейкоза у детей
- Лечение лейкоза у детей
- Прогноз лейкоза у детей
- Цены на лечение
Общие сведения
Лейкоз у детей (лейкемия) – системный гемобластоз, сопровождающийся нарушением костномозгового кроветворения и замещением нормальных клеток крови незрелыми бластными клетками лейкоцитарного ряда. В детской онкогематологии частота лейкозов составляет 4-5 случаев на 100 тыс. детей. Согласно статистике, острый лейкоз является самым частым онкологическим заболеванием детского возраста (примерно 30%); наиболее часто рак крови поражает детей в возрасте 2-5 лет. Актуальной проблемой педиатрии служит наблюдаемая в последние годы тенденция к росту заболеваемости лейкозами среди детей и сохраняющаяся высокая летальность.

Причины лейкоза у детей
Некоторые аспекты развития лейкоза у детей до настоящего времени остаются неясными. На современном этапе доказано этиологическое влияние радиационного излучения, онкогенных вирусных штаммов, химических факторов, наследственной предрасположенности, эндогенных нарушений (гормональных, иммунных) на частоту возникновения лейкоза у детей. Вторичный лейкоз может развиться у ребенка, перенесшего в анамнезе лучевую или химиотерапию по поводу другого онкологического заболевания.
На сегодняшней день механизмы развития лейкоза у детей принято рассматривать с точки зрения мутационной теории и клоновой концепции. Мутация ДНК кроветворной клетки сопровождается сбоем дифференцировки на стадии незрелой бластной клетки с последующей пролиферацией. Таким образом, лейкозные клетки – есть не что иное, как клоны мутировавшей клетки, неспособные к дифференцировке и созреванию и подавляющие нормальные ростки кроветворения. Попадая в кровь, бластные клетки разносятся по всему организму, способствуя лейкемической инфильтрации тканей и органов. Метастатическое проникновение бластных клеток через гематоэнцефалический барьер приводит к инфильтрации оболочек и вещества головного мозга и развитию нейролейкоза.
Отмечено, что у детей с болезнью Дауна лейкоз развивается в 15 раз чаще, чем у других детей. Повышенный риск развития лейкоза и других опухолей имеется у детей с синдромами Ли-Фраумени, Клайнфельтера, Вискотт-Олдрича, Блума, анемией Фанкони, первичными иммунодефицитами (Х-сцепленной агаммаглобулинемией, атаксией-телеангиэктазией Луи-Барр и др.), полицитемией и др.
Классификация лейкоза у детей
На основании продолжительности заболевания выделяют острую (до 2-х лет) и хроническую (более 2-х лет) формы лейкоза у детей. У детей в абсолютном большинстве случаев (97%) встречаются острые лейкозы. Особую форму острого лейкоза у детей представляет врожденный лейкоз.
С учетом данных морфологических характеристик опухолевых клеток острые лейкозы у детей делятся на лимфобластные и нелимфобластные. Лимфобластный лейкоз развивается при бесконтрольной пролиферации незрелых лимфоцитов – лимфобластов и может быть трех типов: L1 – с малыми лимфобластами; L2 – с большими полиморфными лимфобластами; L3 – с большими полиморфными лимфобластами с вакуолизацией цитоплазмы. По антигенным маркерам различают 0-клеточные (70-80%), Т-клеточные (15-25%) и В-клеточные (1-3%) острые лимфобластные лейкозы у детей. Среди острых лимфобластных лейкозов у детей чаще встречается лейкоз с клетками типа L1.
В ряду нелимфобластных лейкозов, в зависимости от преобладания тех или иных бластных клеток, различают миелобластный малодифференцированный (M1), миелобластный высокодифференцированный (М2), промиелоцитарный (М3), миеломонобластный (М4), монобластный (М5), эритромиелоз (М6), мегакариоцитарный (М7), эозинофильный (М8), недифференцированный (М0) лейкоз у детей.
В клиническом течении лейкоза у детей выделяют 3 стадии, с учетом которых выстраивается лечебная тактика.
- I – острая фаза лейкоза у детей; охватывает период от манифестации симптомов до улучшения клинико-гематологических показателей в результате проводимой терапии;
- II – неполная или полная ремиссия. При неполной ремиссии отмечается нормализация гемограммы и клинических показателей; количество бластных клеток в пунктате костного мозга составляет не более 20%. Полная ремиссия характеризуется наличием в миелограмме не более 5% бластных клеток;
- III – рецидив лейкоза у детей. На фоне гематологического благополучия появляются экстрамедуллярные очаги лейкозной инфильтрации в нервной системе, яичках, легких и др. органах.
Симптомы лейкоза у детей
В большинстве случаев клиника лейкоза развивается исподволь и характеризуется неспецифическими симптомами: утомляемостью ребенка, нарушением сна, снижением аппетита, оссалгиями и артралгиями, немотивированным повышением температуры тела. Иногда лейкоз у детей манифестирует внезапно с интоксикационного или геморрагического синдрома.
У детей, страдающих лейкозом, отмечается выраженная бледность кожных покровов и слизистых оболочек; иногда кожа приобретает желтушный или землистый оттенок. Вследствие лейкемической инфильтрации слизистых оболочек у детей нередко возникают гингивит, стоматит, тонзиллит. Лейкемическая гиперплазия лимфатических узлов проявляется лимфаденопатией; слюнных желез – сиаладенопатией; печени и селезенки – гепатоспленомегалией.
Для течения острого лейкоза у детей типичен геморрагический синдром, характеризующийся кровоизлияниями в кожу и слизистые, гематурией, носовыми, маточными, желудочно-кишечными, легочными кровотечениями, кровоизлияниями в полость суставов и др. Закономерным спутником острого лейкоза у детей является анемический синдром, обусловленный угнетением эритропоэза и кровотечениями. Выраженность анемии у детей зависит от степени пролиферации бластных клеток в костном мозге.
Кардиоваскулярные расстройства при лейкозах у детей могут выражаться развитием тахикардии, аритмии, расширением границ сердца (по данным рентгенографии органов грудной клетки), диффузными изменениями миокарда (по данным ЭКГ), снижением фракции выброса (по данным ЭхоКГ).
Интоксикационный синдром, сопровождающий течение лейкоза у детей, протекает со значительной слабостью, лихорадкой, потливостью, анорексией, тошнотой и рвотой, гипотрофией. Проявлениями иммунодефицитного синдрома при лейкозе у детей служит наслоение инфекционно-воспалительных процессов, которые могут принимать тяжелое, угрожающее течение. Гибель детей, страдающих лейкозом, нередко происходит вследствие тяжелой пневмонии или сепсиса.
Крайне опасным осложнением лейкоза у детей является лейкемическая инфильтрация головного мозга, мозговых оболочек и нервных стволов. Нейролейкоз сопровождается головокружением, головной болью, тошнотой, диплопией, ригидностью затылочных мышц. При инфильтрации вещества спинного мозга возможно развитие парапареза ног, нарушения чувствительности, тазовых расстройств.
Диагностика лейкоза у детей
Ведущая роль в первичном выявлении лейкозов у детей принадлежит педиатру; дальнейшее обследование и ведение ребенка осуществляется детским онкогематологом. Основу диагностики лейкозов у детей составляют лабораторные методы: исследование периферической крови и костного мозга.
При остром лейкозе у детей выявляются характерные изменения в общем анализе крови: анемия; тромбоцитопения, ретикулоцитопения, высокая СОЭ; лейкоцитоз различной степени или лейкопения (редко), бластемия, исчезновение базофилов и эозинофилов. Типичным признаком служит феномен «лейкемического провала» – отсутствие промежуточных форм (юных, палочкоядерных, сегментоядерных лейкоцитов) между зрелыми и бластными клетками.
Стернальная пункция и исследование миелограммы являются обязательными в диагностике лейкоза у детей. Решающим аргументом в пользу заболевания служит содержание бластных клеток от 30% и выше. При отсутствии четких данных за лейкоз у детей по результатам исследования костного мозга, прибегают к трепанобиопсии (пункции подвздошной кости). Для определения различных вариантов острого лейкоза у детей выполняются цитохимические, иммунологические и цитогенетические исследования. С целью подтверждения диагноза нейролейкоза проводится консультация детского невролога и детского офтальмолога, люмбальная пункция и исследование цереброспинальной жидкости, рентгенография черепа, офтальмоскопия.
Вспомогательное диагностическое значение имеют УЗИ лимфатических узлов, УЗИ слюнных желез, УЗИ печени и селезенки, УЗИ мошонки у мальчиков, рентгенография органов грудной клетки, КТ у детей (для выявления метастазов в различных анатомических регионах). Дифференциальную диагностику лейкозов у детей следует проводить с лейкозоподобной реакцией, наблюдаемой при тяжелых формах туберкулеза, коклюше, инфекционном мононуклеозе, цитомегаловирусной инфекции, сепсисе и имеющей обратимый транзиторный характер.
Лечение лейкоза у детей
Дети с лейкозами госпитализируются в специализированные учреждения онкогематологического профиля. В целях профилактики инфекционных осложнений ребенок помещается в отдельный бокс, условия в котором максимально приближенны к стерильным. Большое внимание уделяется питанию, которое должно быть полноценным и сбалансированным.
Основу лечения лейкозов у детей составляет полихимиотерапия, направленная на полную эрадикацию лейкозного клона. Протоколы лечения, используемые при острых лимфобластных и миелобластных лейкозах, различаются комбинацией химиопрепаратов, их дозами и способами введения. Поэтапное лечение острого лейкоза у детей предполагает достижение клинико-гематологической ремиссии, ее консолидацию (закрепление), поддерживающую терапию, профилактику или лечение осложнений.
В дополнение к химиотерапии может проводиться активная и пассивная иммунотерапия: введение лейкозных клеток, вакцины БЦЖ, противооспенной вакцины, интерферонов, иммунных лимфоцитов и др. Перспективными методами лечения лейкоза у детей служит трансплантация костного мозга, пуповинной крови, стволовых клеток.
Симптоматическая терапия при лейкозах у детей включает переливание эритроцитарной и тромбоцитарной массы, проведение гемостатической терапии, антибиотикотерапию инфекционных осложнений, дезинтоксикационные мероприятия (внутривенные инфузии, гемосорбцию, плазмосорбцию, плазмаферез).
Прогноз лейкоза у детей
Перспективы развития заболевания определяются многими факторами: возрастом возникновения лейкоза, цитоиммунологическим вариантом, стадией диагностирования и т. д. Худший прогноз следует ожидать у детей, заболевших острым лейкозом в возрасте до 2-х лет и старше 10-ти лет; имеющих лимфаденопатию и гепатоспленомегалию, а также нейролейкоз на момент установления диагноза; Т- и В-клеточные варианты лейкоза, бластный гиперлейкоцитоз. Прогностически благоприятными факторами служат острый лимфобластный лейкоз L1 типа, раннее начало лечения, быстрое достижение ремиссии, возраст детей от 2 до 10 лет. У девочек с острым лимфобластным лейкозом вероятность излечение несколько выше, чем у мальчиков.
Отсутствие специфического лечения лейкоза у детей сопровождается 100%-ной летальностью. На фоне современной химиотерапии пятилетнее безрецидивное течение лейкоза отмечается у 50-80% детей. О вероятном выздоровлении можно говорить после 6-7 лет отсутствия рецидива. Во избежание провокации рецидива детям не рекомендуется физиотерапевтическое лечение, изменение климатических условий. Вакцинопрофилактика проводится по индивидуальному календарю с учетом эпидемической ситуации.
Лейкоз у детей
Что такое Лейкоз у детей –
Лейкоз у детей (лейкемия) – заболевание, которое сопровождается нарушением костномозгового кроветворения и замещением нормальных клеток крови незрелыми бластными клетками лейкоцитарного ряда. Из ста тысяч детей болеет около 4-5. Среди детских онкологических заболеваний удельный вес случаев лейкоза составляет 30%, рак крови поражает наиболее часто малышей от 2 до 5 лет.
В последние годы заболеваемость пациентов маленького возраста растет, высокая летальность всё еще сохраняется.
Формы лейкоза у детей:
- острая (менее 2 лет)
- хроническая (от 2 лет)
В 97 случаях из 100 у детей диагностируют острый лейкоз. Особая его форма – врожденная.
Виды острого лейкоза:
- лимфобластный
- нелимфобластный
Касательно течения заболевания, исследователи выделяют 3 стадии, от которых зависит тактика терапии:
- I – острая фаза лейкоза у детей
- II – неполная или полная ремиссия
- III – рецидив лейкоза у детей
Что провоцирует / Причины Лейкоза у детей:
Сегодня доказанной является роль онкогенных вирусных штаммов, радиационного излучения, наследственной предрасположенности, химических факторов, эндогенных нарушений на возникновение лейкоза у детей. Лейкоз вторичный может появиться в результате лучевой или химиотерапии, которые были проведены для лечения другого заболевания (окнологического).
У детей с диагнозом «болезнь Дауна» лейкоз бывает примерно в 15 раз чаще, чем у детей без такой болезни. Также в группе риска дети с такими заболеваниями:
- синдром Клайнфельтера
- синдром Ли-Фраумени
- синдром Блума
- синдром Вискотт-Олдрича
- первичные иммунодефициты
- анемия Фанкони
- полицитемия и т.д.
Факторы риска при лейкозах у детей
Факторами риска считаются любые влияния, которые увеличивают вероятность заболевания ребенка лейкозом. Сюда относят вредные привычки, нездоровое питание, многочасовое пребывание на солнце. Важную роль играют генетические факторы риска, которые были перечислены выше.
Если у одного из сиблингов в возрасте до 6 лет возник острый лейкоз, то вероятность 20-25%, что лейкоз обнаружат со временем и у второго сиблинга.
Больные, которые получают интенсивную терапию с целью угнетения иммунных функций, имеют повышенный риск развития опухолей, особенно лимфоидной системы, в том числе острого лимфобластного лейкоза.
Патогенез (что происходит?) во время Лейкоза у детей:

У нормальной кроветворной клетки снижается резистентность и повышается чувствительность к действию различных канцерогенов и коканцерогенов. Далее клетка мутирует. Кроветворная клетка превращается в опухолевую. Далее следует опухолевая прогрессия. Причем сначала длительный период происходит безграничная моноклональная пролиферация — так называемая доброкачественная прогрессия.
Следующий этап патогенеза – повторная мутация опухолевых клеток, которые приводят к появлению субклонов-поликлонов. Как итог – происходит злокачественная опухолевая прогрессия. Для всех лейкозных клеток, как было доказано исследователями, характерны выраженные расстройства их структуры, метаболизма, гистохимических особенностей и функций.
Продолжительность существования бластных клеток удлиняется, а функциональная активность (фагоцитарная, двигательная, ферментативная, регуляторная) снижается.
Симптомы Лейкоза у детей:
Лейкоз проявляется неспецифическими симптомами:
- нарушения сна
- утомляемость
- оссалгии
- снижение аппетита
- артралгии
- повышение температуры без причины
В некоторых случаях первым проявлением лейкоза у детей будет геморрагический или интоксикационный синдром.
В части случаев проявляются и такие симптомы лейкоза у детей:
- бледность слизистых и кожи
- желтушный или землистый тон кожи
- стоматит
- гингивит
- тонзиллит
- сиаладенопатия
- лимфаденопатия
- гепатоспленомегалия
Типичные проявления острого лейкоза в детском возрасте:
- гематурия
- кровоизлияния в кожу и слизистые оболочки
- маточные, носовые, легочные, желудочно-кишечные кровотечения
- кровоизлияния в полость суставов
При остром лейкозе у детей может быть выявлен анемический синдром, который возникает как следствие угнетения эритропоэза и кровотечений. Кардиоваскулярные расстройства при лейкозе у ребенка могут проявляться аритмией, тахикардией, диффузными изменениями миокарда (могут быть выявлены по ЭКГ), расширением границ сердца (видно на рентгенограмме), снижением фракции выброса.
Интоксикационный синдром при лейкозе (лейкемии) у детей проявляется так:
- лихорадка
- значительная слабость
- анорексия
- потливость
- гипотрофия
- тошнота и/или рвота
Проявлениями иммунодефицитного синдрома при лейкозе у детей служит наслоение инфекционно-воспалительных процессов, которые могут принимать тяжелое, угрожающее течение. Дети с диагнозом «лейкоз» умирают в части случаев от тяжелой пневмонии или сепсиса.
Среди осложнений лейкемии у детей выделяют лейкемическую инфильтрацию головного мозга, мозговых оболочек и нервных стволов. Нейролейкоз проявляется головными болями, головокружением, диплопией, тошнотой, ригидностью затылочных мышц. При инфильтрации вещества спинного мозга возможно развитие парапареза ног, нарушения чувствительности, тазовых расстройств.
Диагностика Лейкоза у детей:
При подозрении на лейкоз ребенка должен исследовать педиатр, а потом детский онкогематолог. Основной диагностики являются лабораторные методы: исследование периферической крови и костного мозга.
При остром лейкозе у ребенка выявляют в общем анализе крови типичные изменения:
– лейкоцитоз различной степени или лейкопения
– исчезновение базофилов и эозинофилов
Типичным признаком служит так называемый феномен «лейкемического провала»: между зрелыми и бластными клетками нет промежуточных форм.
Лейкоз диагностируют обязательно с проведением стернальной пункции и миелограммы. О болезни говорит содержание бластных клеток 30% и более. Если исследования костного мозга не дали четких результатов, ребенку делают трепанобиопсию. Чтобы определить вариант острого лейкоза, проводят такие исследования: иммунологические, цитохимические, цитогенетические.
Подтверждение диагноза проводится при участии детского офтальмолога и детского невролога. Также проводится в некоторых случаях рентгенография черепа, люмбальная пункция и исследование цереброспинальной жидкости, офтальмоскопия.
Вспомогательные методы диагностики лейкоза у детей:
- УЗИ слюнных желез
- УЗИ лимфоузлов
- УЗИ мошонки у мальчиков
- УЗИ печени и селезенки
- компьютерная томография у детей
- рентгенография органов грудной клетки
Лейкоз при диагностике врачи отличаются от лейкозоподобной реакции, которая бывает при коклюше, тяжелых формах туберкулеза, цитомегаловирусной инфекции, инфекционном мононуклеозе, сепсисе. При таких заболеваниях проявления лейкоза могут иметь обратимый характер.
Как установить стадию лейкоза?
Лейкозы стадируются не так, как большинство случаев рака. С самого начала болезни поражена периферическая кровь и костный мозг. Нужно выявить проникновение клеток лейкоза в селезенку, печень, лимфоузлы, ЦНС, яички, яичники.
Если в центральной нервной системе лейкозные клетки есть в большом количестве, то их фиксируют при помощи исследования спинномозговой жидкости под микроскопом. Если клетки выявлены, ребенку нужно более интенсивное лечение.
Прогностические факторы при лейкозе (лейкемии) у детей:
- Возраст на момент обнаружения болезни
- Возраст больного и исходное количество лейкоцитов
- Пол
- Количество лейкоцитов
- Раса
- Количество хромосом
- Иммунофенотипирование лейкозных клеток
- Ответ на лечение
- Хромосомные транслокации
Лечение Лейкоза у детей:
При обнаружении лейкоза ребенка нужно госпитализировать в специализированное учреждение онкогематологического профиля. Чтобы не возникли инфекционные осложнения, ребенка помещают в отдельный бокс, условия в котором максимально приближенны к стерильным. Рацион больного обязательно должен быть сбалансированным и полноценным.
Для лечения лейкозов необходима полихимиотерапия, направленная на полную эрадикацию лейкозного клона. При острых лимфобластных и миелобластных лейкозах необходима различная комбинация химиопрепаратов, дозы и способы введения.
Этапы лечения:
- достижение ремиссии болезни
- закрепление ремиссии
- поддерживающая терапия
- профилактика / лечение осложнений
Химиотерапию в части случаев дополняют активной и пассивной иммунотерапией: вакцинами БЦЖ, введением лейкозных клеток, интерферонами, противооспенной вакциной и т.д. Сегодня исследуется эффективность методов трансплантации пуповинной крови, костного мозга, стволовых клеток.
Также необходимо симптоматическое лечении при лейкемии у детей:
- проведение гемостатической терапии
- переливание эритроцитарной и тромбоцитарной массы
- дезинтоксикационные мероприятия (гемосорбция, внутривенные инфузии, плазмаферез, плазмосорбция)
- антибиотикотерапия инфекционных осложнений
Прогноз лейкоза у детей
Прогноз зависит от возраста ребенка, когда у него возник лейкоз, от стадии диагностирования и прочих факторов. Худший прогноз дают детям, у которых лейкоз возник в возрасте до 2-х лет и старше 10-ти лет; у детей с диагнозом гепатоспленомегалии и лимфаденопатии; с нейролейкозом на момент диагностирования лейкемии. Также плохой прогноз у детей с Т- и В-клеточными вариантами лейкоза, при бластном гиперлейкоцитозе.
Благоприятный прогноз при остром лимфобластном лейкозе L1 типа; в случаях раннего начала лечения, при быстром достижении ремиссии; у детей в возрасте 2-10 лет. У девочек с острым лимфобластным лейкозом вероятность излечение несколько выше, чем у мальчиков.
При непроведении специфического лечения лейкоза у детей, гарантирован смертельный исход. Современная химиотерапия позволяет обеспечить отсутствие рецидивов на протяжении 5 лет у большинства детей. О вероятном выздоровлении можно говорить, если рецидива лейкоза не было 6-7 лет.
Профилактика Лейкоза у детей:
Необходимо снизить факторы риска, которые перечислялись выше. Дети с известным фактором риска развития лейкоза, например, при синдроме Ли-Фраумени или синдроме Дауна, должны находиться под тщательным периодическим наблюдением.
Нужно избегать изменения климатических условий и физиотерапевтического лечения, чтобы не спровоцировать рецидив лейкоза у детей. Вакцинопрофилактика проводится по индивидуальному календарю с учетом эпидемической ситуации.
К каким докторам следует обращаться если у Вас Лейкоз у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Лейкоза у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Euro lab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Euro lab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Euro lab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Симптомы и лечение лейкоза у детей

- Общая информация о лейкозе
- Провоцирующие факторы
- Виды, типы и стадии
- Симптомы
- Анализы при лейкозе
- Терапия заболевания
- Прогноз
- Рекомендации
- Видео

Лейкоз у детей чаще всего диагностируется в возрасте от 2 до 5 лет
Общая информация о лейкозе
Заболевание характеризуется дефектом кроветворения в костном мозге. Там, где должны созревать защитные белые тельца (лейкоциты), образуются бластные клетки, недозревшие и не способные выполнять свои функции.
Попадая в кровь, такие форменные элементы нарушают нормальное клеточное соотношение, проникают во многие органы и скапливаются там. При попадании в головной мозг недозревшие лейкоциты провоцируют развитие нейролейкоза – поражения мозговых оболочек и нервных структур.
Лейкоз является одной из распространенных причин детской смертности.
Провоцирующие факторы
Причины возникновения патологии изучены не полностью. Предполагается влияние генетических факторов, вирусных инфекций. Бывают случаи наследования онкогенов, которые проявляют активность уже в перинатальном периоде.
По статистике однояйцевые близнецы чаще страдают лейкозом, нежели разнояйцевые. Это подтверждает влияние наследственного фактора как основной причины. Риск развития патологии высок у детей с такими наследственными заболеваниями, как синдром Блума, болезнь Дауна, первичный иммунодефицит, синдром Клайнфельтера и пр.
Зафиксирован высокий процент заболевших среди людей, перенесших облучение из-за ядерных взрывов на ЧАЭС и в Хиросиме.
Лейкемия может возникать на фоне проведенной лучевой или химиотерапии, назначенной для лечения других онкологических заболеваний.
Виды, типы и стадии
Симптомы лейкоза не всегда проявляются остро, анализ крови может быть в норме
Опираясь на морфологию атипичных клеток, выделяют два вида патологии:
Лимфобластный лейкоз – характеризуется бесконтрольным распространением бластных клеток, которые могут быть малыми, большими, полиморфными. В детском возрасте чаще встречается острая форма патологии. Вероятность развития у малышей хронического лимфобластного лейкоза ничтожно мала.
По признаку антигенной специфичности лимфобластный лейкоз подразделяют на три типа:
- Т-клеточный. Составляет до четверти случаев заболевания.
- Нуль-клеточный. Встречается в 70-80%.
- В-клеточный. Самый редкий (до 3%).
В некоторых случаях могут диагностировать лейкоз неуточненного типа, но обычно он встречается у взрослых пациентов.
Нелимфобластный лейкоз – характеризуется поражением миелоидного ростка крови, что является причиной быстрого размножения измененных лейкоцитов. В соответствии с морфологией клеточных элементов, патологию подразделяют на несколько разновидностей:
- М 0 – недифференцированный лейкоз у детей;
- М 1 – малодифференцированный;
- М 2 – высокодифференцированный;
- М 3 – промиелоцитарный;
- М 4 – миеломонобластный;
- М 5 – монобластный;
- М 6 – эритромиелоцитоз;
- М 7 – мегакариоцитарный лейкоз;
- М 8 – эозинофильный.
Нелимфобластный лейкоз диагностируется у детей в 15-25% от общего числа заболевших. Характерен для более старших пациентов, имеющих в анамнезе противоопухолевую терапию, синдром Блума или анемию Фанкони.
Клиническая картина зависит от стадии развития болезни:
- Острая.
- Ремиссия.
- Рецидив.
Это влияет и на клиническую симптоматику, которая может существенно измениться с течением времени.
Симптомы
Первые признаки лейкоза проявляются резко или постепенно, но в большинстве случаев лейкемия у детей сопровождается внезапным повышением температуры, слабостью, кровотечениями, часто повторяющимися инфекционными заболеваниями.
Начинаясь постепенно, лейкоз может сопровождаться следующими симптомами:
- боль в мышцах, суставах, костях;
- упадок сил, усталость;
- потеря аппетита, тошнота;
- снижение веса;
- плохой сон;
- скачки температуры;
- гипергидроз;
- головная боль.
Такие признаки входят в структуру интоксикационного синдрома.
Нередко болезнь сопровождается сыпью на коже, кровоизлияниями во внутренние органы, выделением крови с мочой. Так проявляется геморрагический синдром.
Кроме того, патология может сопровождаться кардиоваскулярным синдромом, который проявляется в учащении пульса, нарушении сердечного ритма, лабильностью артериального давления, вазомоторными реакциями. Отклонения от нормы фиксируются на ЭКГ.
Опасным признаком лейкемии считается иммунодефицитный синдром. На фоне патологического снижения защитных функций организм ребенка не может справляться с постоянными инфекциями, развиваются тяжелые формы воспаления, сепсис.
При внешнем осмотре и физикальном обследовании можно отметить наличие следующих признаков:
- вялость, апатия, быстрая утомляемость;
- одышка;
- бледность кожного покрова и слизистых с кровоподтеками;
- увеличение размеров лимфатических узлов, селезенки, печени.
По мере прогрессирования болезни симптомы становятся более выраженными.
Анализы при лейкозе
Лейкоз крови может проявляться частыми ангинами
В большинстве случаев заподозрить острый лейкоз можно по характерным изменениям общего анализа крови. В этом случае ребенок оперативно направляется на прием к онкогематологу для дальнейшей диагностики – расширенной гемограммы и миелограммы.
Анализ периферической крови при лейкозе показывает следующие отклонения:
- нормоцитарная анемия;
- снижение количества тромбоцитов;
- ретикулоцитопения;
- повышение скорости оседания эритроцитов;
- перекос количества лейкоцитов, свдиг формулы влево;
- бластемия;
- критическое снижение эозинофилов и промежуточных видов белых кровяных клеток.
Если показатели гемограммы в норме, но клинические признаки вызывают подозрение, то онкогематолог назначает комплекс дополнительных исследований: обнаружение специфических маркеров, цитохимию.
Окончательно определиться с диагнозом поможет миелограмма. Для микроскопического исследования добывают пунктат костного мозга, в котором отражается состав миелоидной ткани. Если показатель лейкобластных клеток превышает 30%, то лейкоз подтверждается.
Кроме миелограммы диагностической ценностью обладают цитохимическое исследование, цитогенетический, иммунологический анализы.
При появлении первых признаков осложнений лейкоза, включая поражение структур нервной системы, ребенку назначаются обследование у невролога, рентген головы, офтальмоскопия, пункция спинномозговой жидкости.
Для определения лейкозной инфильтрации внутренних органов проводят УЗИ, МРТ, КТ, радиоизотопное сканирование.
Терапия заболевания
Лечение детей с диагнозом “острый лейкоз” проводится исключительно в стационарных условиях. Ребенка госпитализируют в стерильные блоки онкологического отделения, где создают условия для защиты организма от вирусов и бактерий.
Устранить раковые клетки помогает химиотерапия. Это единственно эффективное лечение, которое дает шансы на выживание. В зависимости от вида и стадии лейкемии, применяются разные схемы химиотерапии, различные дозировки, способы введения и сочетания препаратов.
Питание больного ребенка должно быть полноценным и сбалансированным по составу на протяжении всего лечения и дальнейшей жизни.
Назначить адекватную терапию может только врач после изучения анализов при лейкозе и глубокой диагностики.
Добившись стойкой ремиссии, лечение повторяют каждые 2 месяца с целью профилактики рецидивов.
Для устранения выраженности симптомов параллельно могут проводить переливание донорской крови, введение антибактериальных и кровоостанавливающих средств, очищение крови (плазмаферез).
Прогноз

Лимфобластный лейкоз у детей бывает трех типов
Смертность детей от лейкоза высока. Шансы на выздоровление во многом зависят от оперативности диагностики и начатого лечения. Своевременная терапия лимфоидного и миелобластного лейкоза дают хороший прогноз, у ребенка есть шансы на стойкую ремиссию и даже полное избавление от болезни.
Спрогнозировать течение болезни помогают следующие факторы:
- возрастная категория – лечению легче поддаются дети от 2 до 10 лет;
- пол – у девочек шансы выше;
- стадия болезни;
- вид лейкоза – самыми опасными считаются В и Т-клеточный лейкоз миелобластного типа.
Отсутствие своевременного и адекватного лечения заканчивается летальным исходом. Кроме того, риски значительно повышаются при туберкулезе, пневмонии, инфекционном мононуклеозе, ЦМВ инфекции.
Шансы на выздоровление увеличиваются многократно, если после перенесенной химиотерапии у ребенка наблюдается стойкая ремиссия на протяжении более 6 лет.
Рекомендации
Здоровье ребенка должно быть под строгим контролем родителей. Любые изменения общего состояния – поведения, самочувствия, аппетита – должны выявляться своевременно. При наличии сомнений следует обращаться к педиатру, который выполнит первичную диагностику и направит малыша для дальнейшего обследования к узким специалистам: гематологу, онкологу, неврологу и пр.
Только оперативная госпитализация и безотлагательная терапия могут дать малышу шансы на выздоровление. Прогноз для дальнейшей жизни ребенка можно сделать только после проведения полной и глубокой диагностики, которая включает в себя стернальную пункцию.
Чтобы предотвратить рецидивы заболевания, детям рекомендуется избегать физиотерапевтических процедур, смены климата, инфекционной патологии, стрессовых факторов.
Лейкоз крови – не приговор, если предпринять максимум мер по его лечению и профилактике рецидивов. Современные химиопрепараты в более чем 50% случаев останавливают развитие патологии на срок до 5 лет.
Видео
Симптомы и лечение лейкоза у детей
Фото предоставлено рекламодателем
Среди детских и подростковых злокачественных заболеваний лидирующую позицию по степени распространенности занимает лейкоз. Иногда его называют «белокровием», «лейкемией» или просто «раком крови», однако все эти понятия являются тождественными и объединяют группу гематологических болезней, при которых нормальные клетки крови замещаются лейкозными.
Классические симптомы лейкоза у детей включают признаки интоксикации, геморрагического синдрома, снижения иммунитета и нарушения работы сердечно-сосудистой системы. Эти отклонения могут косвенно подсказать, как обнаружить развитие онкологии, однако для точной диагностики крайне важна квалифицированная и своевременная медицинская помощь.
Разберемся, как проявляется лейкоз у детей в зависимости от формы и стадии патологического процесса, как определить начало заболевания и вовремя принять адекватные меры, чтобы улучшить прогноз.
Симптомы и признаки лейкоза у детей
Клиническая картина детского лейкоза может выглядеть по-разному – все зависит от стадии и конкретного вида болезни, ее агрессивности и индивидуальных особенностей пациента. К списку наиболее распространенных симптомов лейкемии у подростков и детей младших возрастных групп относятся:
- повышенная до фебрильных значений температура без видимых на то причин;
- слабый иммунный ответ и, как следствие, частые простудные заболевания;
- повышенная утомляемость, апатия, беспричинная слабость;
- кровоточивость слизистых и гематомы, появляющиеся даже от незначительного воздействия;
- бледность кожных покровов;
- частые приступы костных и суставных болей.
К сожалению, этот набор неспецифических отклонений далеко не всегда способен точно подсказать, как распознать лейкоз у ребенка – такие признаки могут свидетельствовать о десятках различных заболеваний. Тем не менее, если вы заметили у малыша хотя бы несколько симптомов белокровия из приведенного списка, следует как можно скорее обратиться к врачу – это позволит вовремя провести диагностику и, при необходимости, начать лечение.
Клиника онкологического заболевания будет расширяться в зависимости от стадии и агрессивности процесса. Давайте рассмотрим, как начинается лейкоз у детей и какие симптомы присоединяются по мере усугубления болезни.
Лейкоз у ребенка в начальной стадии
При развитии онкологического заболевания нарушается процесс кроветворения, в результате чего нормальные клетки крови – эритроциты, лейкоциты и тромбоциты – замещаются раковыми. Поэтому симптомы лейкоза у детей в начальной стадии напрямую связаны с нарушением функций, которые в норме выполняют клетки крови:
- Недостаток эритроцитов приводит к кислородному голоданию органов и тканей. В результате пациент чувствует общее недомогание, беспричинную усталость и упадок сил.
- Снижение уровня тромбоцитов приводит к развитию геморрагического синдрома, для которого характерны кровотечения и гематомы.
- Первые признаки лейкоза у детей, связанные с недостатком лейкоцитов, затрагивают иммунную систему. Как правило, в этом случае ребенок чаще простужается и тяжелее переносит даже банальную ОРВИ.
Развитие опухоли может носить острую или хроническую форму. В первом случае симптомы будут развиваться постепенно, во втором – стремительно прогрессировать, приводя к резкому ухудшению самочувствия. У детей острый лейкоз встречается в десятки раз чаще – хронические формы составляют лишь около 3% от общего числа лейкемий.
Как проявляется лейкоз в поздней стадии
По мере развития заболевания признаки лейкоза у детей становятся более выраженными. Низкий уровень лимфоцитов приводит к снижению иммунитета, поэтому пациент тяжело реагирует на любую инфекцию. Усиливается геморрагический синдром, а слабость и апатия становятся очевидными.
Распространяясь по организму, раковые клетки также провоцируют у детей признаки лейкемии, которые, на первый взгляд, не связаны напрямую с системой крови. К ним относится тошнота, рвота, боли в животе, конечностях, проблемы со зрением и координацией.

Виды детской лейкемии: отличия, как проявляются
Классификация лейкоза крови у детей основывается на агрессивности процесса и преобладающем составе вовлеченных клеток. Давайте разберемся, как эти моменты влияют на течение болезни, ее диагностику и вероятный прогноз.
Острый лимфобластный лейкоз (ОЛЛ)
Лимфоидные формы онкологического заболевания крови являются самыми распространенными среди детей и подростков: на их долю приходится 80-90% от общего числа лейкозов и около 25% от всех злокачественных новообразований в педиатрии. В этом случае нарушается процесс созревания лимфоцитов, которые постепенно замещаются незрелыми бластами и вызывают характерные проявления ОЛЛ.
К наиболее распространенным симптомам лимфобластного лейкоза у детей относятся:
- резкое снижение иммунитета и, как следствие, частые случаи инфекционных заболеваний;
- скачки температуры до фебрильных значений;
- анемичный внешний вид, бледность и потеря веса;
- повышенная утомляемость.
Острый лимфобластный лейкоз может развиваться из В- или Т-клеток предшественников. В первом случае поражаются клетки крови, отвечающие за гуморальный иммунитет, а во втором – лимфоциты, контролирующие клеточно-гуморальные реакции. Статистически В-клеточная лейкемия имеет более высокий процент выживаемости, чем Т-клеточная, однако точный прогноз зависит и от других факторов, влияющих на ход болезни и эффективность лечения. В целом, и та, и другая форма успешно лечатся и в 80% случаев заканчиваются стойкой ремиссией.
Острый миелоидный лейкоз (ОМЛ)
ОМЛ – еще одна значимая группа в списке заболеваний, которая составляет 20% всех лейкозов и порядка 6% от всех онкологических диагнозов в педиатрии. Миелоидная форма лейкоза у новорожденных и детей до 2 лет встречается чаще, чем у младших школьников и подростков. Она поражает миелоидные стволовые клетки, из которых в норме образуются эритроциты, тромбоциты и гранулоциты (разновидность лейкоцитов). Поэтому симптомы острого лейкоза у детей в этом случае могут быть представлены широким спектром признаков, включая высокую температуру, плохой аппетит, беспричинную слабость, костные и суставные боли, увеличение лимфоузлов, частые носовые кровотечения и гематомы.
Несмотря на тяжесть симптомов и агрессивность развития болезни, прогноз 5-летней выживаемости среди детей варьируется в пределах 80%, причем этот показатель не является окончательным, поскольку протоколы лечения постоянно совершенствуются.
Хронический миелоидный лейкоз (ХМЛ)
В 3-5% случаев лейкемия у детей носит хронический характер. Такое заболевание развивается очень медленно и на начальных стадиях практически никак себя не проявляет. До появления первых признаков детского лейкоза в этом случае может пройти несколько недель, а иногда и месяцев. Насторожить родителей должна ночная потливость, слабость, утомляемость ребенка, снижение веса без коррекции рациона, жалобы на болезненные ощущения в костях, суставах, под грудной клеткой.
Почему у детей лейкоз иногда отличается вялым течением и можно ли предположить развитие онкологии такого типа? В 95% случаев у пациентов с ХМЛ выявляется генетическая мутация под названием «филадельфийская хромосома». Такая ошибка в генах является спорадической и не передается по наследству, поэтому предугадать ее появление невозможно.
Ювенильный миеломоноцитарный лейкоз (ЮММЛ)
ЮММЛ – самая редкая форма лейкоза, которая встречается только у детей грудного и младшего возраста (преимущественно до 2 лет). Заболевание возникает в том случае, когда из кроветворных клеток образуются моноциты и миелоциты, которые накапливаются в крови, селезенке, печени и костном мозге. Симптомы лейкемии у детей в этом случае могут включать:
- мелкие гематомы красноватого или пурпурного цвета,
- увеличение селезенки и печени,
- отек лимфоузлов,
- беспричинную лихорадку,
- бледность кожных покровов,
- плохой аппетит, проблемы с набором веса и, как следствие, задержку физического развития.
ЮММЛ связывают с наличием широкого спектра генетических мутаций, особенности которых позволяют подобрать оптимальную стратегию лечения и добиться наилучших результатов.

Диагностика детского лейкоза
Симптомы онкологического заболевания крови в педиатрической группе чаще всего развиваются довольно агрессивно. Поэтому крайне важно вовремя поставить правильный диагноз и начать лечение – это позволит не упустить ситуацию и значительно улучшить прогноз детского лейкоза. Диагностика болезни обычно включает широкий перечень исследований, в число которых входят:
- Первичный осмотр. На этом этапе необходимо подробно рассказать врачу, как вы заподозрили лейкоз и как прогрессировала симптоматика. После этого специалист проведет общий осмотр, оценит состояние ребенка и составит список анализов, необходимых для постановки диагноза.
- Лабораторные и инструментальные исследования. Для дальнейшей диагностики лейкоза у детей могут потребоваться развернутые анализы крови с обязательным подсчетом лейкоцитарной формулы, цитологическое и цитохимическое исследование материала, полученного в результате пункции костного мозга, люмбальная пункция для изучения спинномозговой жидкости, рентгенологическое исследование, КТ, УЗИ и другие анализы и процедуры.
Лечение и профилактика лейкоза
На сегодняшний день терапия лейкемии в педиатрической группе является высокотехнологичным и довольно эффективным процессом, который может включать различные методики лечения. В каждом случае протокол подбирается индивидуально с учетом особенностей истории болезни и состояния конкретного пациента.
Методы
К наиболее эффективным методикам относятся:
- Химиотерапия – основной способ лечение лейкоза у детей. Курс включает введение цитостатиков, которые подавляют рост и размножение раковых клеток. Действие препарата частично отражается и на здоровых клетках, однако наличие побочных эффектов в этом случае не идет ни в какое сравнение с положительной динамикой при терапии онкологического заболевания.
- Таргетная терапия – методика «нового поколения», которая затрагивает только злокачественные клетки, не вовлекая в процесс лечения здоровые. Такой способ воздействия является «точечным», поэтому для его реализации раковые клетки должны включать специальные мишени. Выявить эту особенность можно в ходе диагностики.
- Трансплантация гемопоэтических стволовых клеток не относится к стандартному протоколу. Ее назначают только пациентам из высокой группы риска, при рецидиве или тяжелом течении болезни с плохим прогнозом.
- Лучевая терапия подразумевает воздействие радиации на пораженные клетки. Метод используется в редких случаях с неблагоприятными прогнозами, поскольку имеет ряд побочных эффектов, в том числе и отдаленных.
Какая бы методика ни применялась, лечение в любом случае проводится только в стационарных условиях. Такой подход, во-первых, позволяет привлечь специалистов различного профиля, а во-вторых, облегчает отслеживание динамики состояния пациента, на основании которой текущий протокол может быть пересмотрен или дополнен.
Профилактика
Предупредить развитие злокачественного новообразования практически невозможно, поскольку причины лейкоза у детей досконально не установлены. Онкология начинает развиваться, как только происходят мутации в клетке-предшественнике, но что приводит к этим изменениям, доподлинно неизвестно.
Риск развития лейкемии возрастает при наличии иммунодефицита и некоторых хромосомных отклонений. Кроме того, определенное влияние на процесс оказывает радиационное воздействие, рентгеновское излучение, отдельные группы вирусов и некоторые химические вещества, в т.ч. медикаментозные. Однако эти факторы являются скорее сопутствующими и далеко не всегда влияют на развитие онкологии, поэтому говорить о действенной профилактике лейкоза у детей не совсем корректно.
Прогноз
Статистика наиболее распространенных форм детской лейкемии является довольно обнадеживающей, поскольку в 80-90% случаев болезнь удается успешно победить. К тому же, современные протоколы позволяют снизить вероятность побочных эффектов. Исключение составляет ЮММЛ – такая форма болезни тяжелее поддается лечению, однако и в этом случае выживаемость превышает 50%. К тому же, методы терапии постоянно совершенствуются, поэтому указанные цифры не являются окончательными.
Следует понимать, что ни в одном конкретном случае врач не может точно предсказать ход заболевания. Поэтому крайне важно верить в успех и поддерживать ребенка на пути к полному выздоровлению вне зависимости от статистики и прогнозов.
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Острый миелоидный лейкоз у детей
Если при ОЛЛ у детей достигнуты значительные успехи в лечении, то результаты лечения ОМЛ остаются недостаточно удовлетворительными. В связи с этим проблема диагностики и лечения ОМЛ у детей является актуальной.
ОМЛ – гетерогенная группа заболевания. Основой для разделения его на различные варианты является морфологическая идентификация лейкозных клеток, которая помимо цитологических данных использует цитохимические показатели.
В 1976 г. была принята Франко-американо-британская (FAB) классификация, которая выделяет среди ОМЛ несколько вариантов: М0 – острый недифференцированный лейкоз, М1 – острый миелобластный лейкоз без признаков созревания, М2 – острый миелобластный лейкоз с признаками созревания, М3 – острый промиелоцитарный лейкоз, М4 – острый миеломонобластный лейкоз, М5 – острый монобластный лейкоз, М6 – острый эритроцитарный лейкоз, М7 – острый мегакариоцитарный лейкоз.
Диагностика
Диагноз ОМЛ устанавливается в более 30% случаев определения бластов в костном мозгу. Бласты должны иметь морфологическую и цитохимическую характеристику одного из FAB вариантов ОМЛ.
Цитохимические данные, направленные на диагностику вариантов заболевания, – положительная реакция на миелопероксидазу, с суданом черным Б и неспецифическую эстеразу, ингибируемую фтористым натрием. При этом совокупность данных показателей различается при разных вариантах ОМЛ. Так, наличие положительной реакции на миелопероксидазу характерно для вариантов М1, М2, М3 и М4, а неспецифическая эстераза, ингибируемая фтористым натрием, специфична для вариантов М4 и М5.
Существенным дополнением для диагностики ОМЛ являются иммунофенотипические исследования, уточняющие стандартную морфологическую диагностику и варианты ОМЛ.
Наиболее распространенными и широко применяемыми для подтверждения нелимфоидной природы лейкоза являются антигены CD13 и CD33, несколько реже используется CD65. Оценка этих трех маркеров позволяет подтвердить миелоидную природу опухолевых клеток в 98% случаев ОМЛ у детей.
Хромосомный анализ необходим для прогнозирования результатов лечения ОМЛ. Приблизительно у 75% детей, больных ОМЛ, можно выявить ту или иную хромосомную аберрацию, среди которых есть аномалии, характерные лишь для определенных вариантов ОМЛ. Так, t(8;21) ассоциируется с М2-вариантом, t(15;17) – с М3-вариантом, inv(16) – с М4-вариантом с эозинофилией. Аномалия 11q23 встречается при вариантах М4 и М5 и t(1;22) при М7-варианте. С помощью методов молекулярно-биологической диагностики – полимеразной цепной реакции (ПЦР) и FISH (fluorescent in situ hybridization) – можно определить хромосомную аберрацию, не выявленную при стандартном цитогенетическом исследовании. Это особенно важно для выбора определенного вида лечения в случае подтверждения М3-варианта. Кроме того, благодаря внедрению методов молекулярной диагностики ОМЛ в настоящее время у больных можно констатировать не только клинико-гематологическую, но и молекулярную ремиссию с последующим слежением за минимальной остаточной болезнью и определением молекулярного рецидива.
Клиническая картина ОМЛ достаточно хорошо известна и проявляется следующими синдромами: анемическим, геморрагическим и токсическим, которые характеризуются бледностью кожных покровов, выраженной слабостью, головокружением, снижением аппетита, повышенной утомляемостью, лихорадкой без проявлений катаральных явлений.
Лимфатические узлы у большинства больных – небольших размеров, безболезненные, не спаяны с кожей и друг с другом. В редких случаях наблюдаются увеличенные лимфатические узлы размером от 2,5 до 5 см с образованием конгломератов в шейно-надключичной области. Изменения в костно-суставной системе в некоторых случаях проявляются выраженными оссалгиями в нижних конечностях и в области позвоночного столба, что сопровождается нарушением движений и походки. На рентгенограммах костной системы отмечаются деструктивные изменения различной локализации, периостальные реакции, явления остеопороза. У большинства детей наблюдается небольшое увеличение печени и селезенки (выступают из-под края реберной дуги на 2-3 см).
Экстрамедуллярные опухолевые поражения чаще проявляются гингивитом и экзофтальмом, в том числе двусторонним; в редких случаях бывают опухолевая инфильтрация мягких тканей, гипертрофия нёбных миндалин, поражение носоглотки и лицевого нерва, а также лейкемиды на коже.
Экстрамедуллярные локализации ОМЛ объединяет термин “гранулоцитарная (миелобластная) саркома”, включающая классическую хлорому и непигментированные опухоли.
По данным аутопсии, гранулоцитарная (миелобластная) саркома диагностируется в 3-8% случаев у больных ОМЛ. Она может предшествовать или сочетаться с признаками ОМЛ, характеризующимися бластной инфильтрацией костного мозга и наличием бластов в периферической крови, а также наблюдаться при рецидиве заболевания. Наиболее частой локализацией опухолевого роста является орбита (поражаются орбитальная ткань и внутренние структуры черепа). Бластные клетки чаще представлены М2-типом, имеющими транслокацию t(8;21). Ряд авторов указывают на более плохой прогноз у этих больных, чем при типичном ОМЛ.
Факторы прогноза у больных ОМЛ менее изучены, чем у больных с ОЛЛ. Было проведено большое количество одно- и многофакторных исследований, с помощью которых появилась возможность определения благоприятных и неблагоприятных признаков заболевания для назначения рационального лечения. Факторы, от которых зависит прогноз ОМЛ у детей, разделяют на клинические и лабораторные. К клиническим можно отнести возраст, пол, анамнез, размеры паренхиматозных органов, выраженность геморрагического синдрома, инициальное поражение ЦНС, время наступления ремиссии, количество курсов химиотерапии. Среди лабораторных прогностических факторов выделяют чувствительность бластных клеток к химиопрепаратам in vitro, количество лейкоцитов в анализе периферической крови, FAB-вариант ОМЛ, уровень фибриногена, уровень лактатдегидрогеназы, наличие палочек Ауэра в бластах.
Прогноз при ОМЛ зависит от FAB-морфологического варианта, данных генетического исследования и иммунофенотипа бластных клеток. Так, наиболее благоприятную группу составляют больные с морфологическими вариантами М1, М2 и t(8;21), t(9;11), М3 и t(15;17) или М4 и inv(16). В неблагоприятную для прогноза группу входят больные с вариантами М4 без inv(16), М5, М6 и М7, а также пациенты, при исследовании кариотипа опухолевых клеток которых были выявлены следующие хромосомные аномалии: t(9;22), t(6;11), t(10;11), del5q-, del7q-, моносомии -5, -7. Кроме того, нашими исследованиями удалось доказать, что на прогноз ОМЛ неблагоприятно влияет экспрессия эритроитных и В-линейных антигенов на поверхности бластов.
Лечение больных ОМЛ основано на принципе максимального уничтожения лейкозного клона клеток. Основным методом лечения заболевания является полихимиотерапия. В настоящее время существует несколько направлений в лечении ОМЛ, включающих в себя как применение новых цитостатиков, так и увеличение доз уже известных химиопрепаратов. Кроме этих уже достаточно изученных и ставших традиционными методов воздействия на лейкозный процесс существуют экспериментальные подходы с использованием естественных биологически активных препаратов, которые тем или иным способом влияют на процесс кроветворения (все ростковые факторы, интерлейкины). Наряду с цитостатическими агентами также пытаются применять лекарственные препараты, которые обладают мощным моделирующим воздействием на иммунную систему (циклоспорин, антилейкоцитарный иммуноглобулин). Использование ростковых факторов при ОМЛ в настоящее время дискутируется в связи с данными о том, что они могут способствовать пролиферации опухолевого клона клеток. В настоящее время некоторыми исследователями доказывается возможность применения колониестимулирующих факторов (граноцит и др.) у больных с ОМЛ.
В последние годы в программы лечения острого нелимфобластного лейкоза (ОНЛЛ) широко внедряется трансплантация костного мозга (ТКМ) – как аллогенная (при наличии HLA-совместимого донора), так и аутологичная трансплантация периферических стволовых клеток или костного мозга.
Современные программы лечения ОМЛ состоят из разных этапов – индукции, консолидации, интенсификации и поддерживающего лечения в период ремиссии (продолжающегося, как правило, не менее 2 лет). Одновременно проводится профилактика нейролейкоза с помощью эндолюмбального введения химиопрепаратов (цитозинарабинозид). В последние годы более широко стала использоваться профилактическая дистанционная гамма-терапия на область головного мозга.
При проведении индуктивного и консолидирующего курсов химиотерапии необходима максимальная интенсификация, что приводит к наиболее быстрому достижению полных ремиссий. Следствием такой терапии является аплазия костного мозга, во время которой резко возрастает вероятность возникновения инфекционных и геморрагических осложнений, в связи с чем больные нуждаются в комплексном сопроводительном лечении, включающем в себя заместительную, антибактериальную и дезинтоксикационную терапию.
Основными препаратами, входящими в используемые программы полихимиотерапии, являются сочетания цитозинарабинозида и антрациклиновых антибиотиков. До 80-х годов применялись схемы ДАТ и “7+3”. С середины 80-х в программы лечения стал внедряться этопозид, что привело к более высокому числу полных ремиссий и увеличению безрецидивной выживаемости больных. Наиболее эффективными программами лечения, включающими этопозид, являются программы BFM-83 и BFM-87. Индукция ремиссии состоит из цитозинарабинозида, даунорубицина и этопозида, а консолидация – из винкристина, даунорубицина, цитозинарабинозида, 6-тиогуанина, преднизолона, циклофосфана с последующей поддерживающей терапией (цитозинарабинозид и 6-тиогуанин до 104 недель с момента наступления ремиссии). По данным исследования BFM-87, пятилетняя бессобытийная выживаемость составила 47%.
Одним из путей интенсификации химиотерапии и достижения более длительных ремиссий является увеличение доз цитозинарабинозида (до 3000 мг/м2 каждые 12 часов).
В последнее время появились работы о применении митоксантрона для лечения ОМЛ у детей, особенно у больных с плохим прогнозом (М5, М7, М6, М4 без эозинофилии и inv(16), М2 с лейкоцитозом более 50х109/л) и при рецидиве заболевания. Наиболее эффективной терапией оказалось сочетание высоких доз цитозара, митоксантрона, этопозида. Данная терапия приводит к выраженной миелодепрессии, без которой невозможно достичь полной ремиссии при ОМЛ, особенно у больных с неблагоприятным прогнозом и рецидивами заболевания. Применение митоксантрона (12 мг/м2) у больных с неблагоприятным прогнозом не привело к увеличению числа осложнений при достижении большего количества полных ремиссий у больных с резистентными к терапии формами ОНЛЛ.
Имеющиеся на сегодняшний день данные говорят о том, что, с одной стороны, интенсификация химиотерапии значительно повысила эффективность лечения, с другой – увеличилось число побочных реакций и осложнений, в некоторых случаях являющихся причиной гибели больных.
Направление лечения, связанное с использованием дифференцирующих агентов, таких как изомеры ретиноевой кислоты, достигло наибольшего результата при терапии острого промиелоцитарного лейкоза (М3). При хромосомной аберрации t(15;17), соответствующей М3 FAB, точка разрыва хромосомы 17 вовлекает ген, соответствующий ядерному рецептору альфаретиноевой кислоты, что дает возможность восстановления пораженного гена и способствует апоптозу опухолевых клеток при сокращении количества эпизодов геморрагических осложнений.
Опыт последних 20 лет показал, что совершенствование технологии сопроводительного лечения, главным образом методов контроля инфекций у больного с индуцированной гранулоцитопенией, и появление методик получения тромбоконцентрата позволили достичь 80% полных ремиссий, несмотря на значительное ужесточение режимов полихимиотерапии. Именно поэтому основными направлениями современных протоколов являются различные варианты интенсификации химиотерапии, которая может осуществляться с помощью ряда вариантов: введение в уже известные протоколы дополнительных цитостатических средств; использование новых цитостатических препаратов в качестве альтернативы изученным, например более активных антрациклинов второго поколения (идарубицина и митоксантрона); цикловая интенсивная химиотерапия на протяжении 1,5-2 лет после достижения ремиссии; модификация стандартных программ химиотерапии на основании кинетических параметров бластных клеток в ходе терапии и характерных особенностей восстановления кроветворения после цитостатического воздействия; применение ростковых факторов для ускорения выхода из постхимиотерапевтической аплазии; раннее применение аутологичной и аллогенной трансплантации костного мозга. Принцип ранней интенсификации в настоящее время является основным в терапии ОМЛ и, по данным многих исследований, имеет преимущество перед стандартным. Он позволяет уменьшить число больных с резистентными формами ОМЛ за счет увеличения мощности цитостатического воздействия на первых, ранних этапах терапии.
При анализе данных разных исследовательских групп становится очевидно, что примерно у половины больных, достигших ремиссии, ОМЛ рецидивируют. Причем 75% рецидивов выявляется в течение первого года от начала терапии, еще 15% – в течение второго года и 10% рецидивов регистрируются позже 2 лет от начала терапии. В связи с этим целью постремиссионной терапии является искоренение остаточного лейкозного клона. Постремиссионная терапия обычно классифицируется следующим образом: 1) терапия консолидации – постремиссионная терапия, сходная по интенсивности с индукцией, с использованием многократно повторяющихся препаратов с неперекрестной резистентностью; 2) терапия интенсификации: постремиссионная терапия, целью которой является преодоление лекарственной резистентности (обычно это препараты, ранее используемые в индукции); 3) поддерживающая терапия: значительно менее интенсивная постремиссионная терапия (в некоторых исследованиях до 3 лет).
В настоящее время доказано, что результаты лечения больных ОМЛ, получавших все этапы полихимиотерапии (индукцию ремиссии и постремиссионную терапию) в полном объеме, значительно выше.
В большинстве протоколов лечения ОМЛ наибольшее распространение получила поддерживающая рекомендуемая BFM- группой терапия, которая состоит из ежедневного приема 6-тиогуанина в дозе 40 мг/м2 в комбинации с подкожным введением цитозинарабинозида (40 мг/м2 х 4) каждые 4 недели. Проводится она сроком до 18 месяцев от начала лечения. Однако с повышением интенсивности постремиссионной терапии длительность поддерживающего лечения сокращается.
Профилактика нейролейкоза состоит из эндолюмбального введения цитозинарабинозида, метотрексата или комбинации этих препаратов с гидрокортизоном, с или без краниального облучения. Ряд авторов считают краниальное облучение больных ОМЛ необходимым компонентом терапии, другие придерживаются мнения, что краниальное облучение необходимо только для детей с первичным поражением нервной системы, а также для больных с вариантом М4, с хромосомными нарушениями inv (16). Предпочтение в проведении краниального облучения высказывают исследователи из группы BFM, которые показали снижение частоты не только нейролейкоза, но и костномозговых рецидивов при ее проведении.
Вопрос о роли аллогенной ТКМ (алло-ТКМ) у детей с ОМЛ в первой клинико-гематологической ремиссии в настоящее время активно дискутируется. Хотя алло-ТКМ является эффективным средством терапии ОМЛ, вопросы наличия донора и токсичности процесса ограничивают ее использование. Ключевым вопросом применения алло-ТКМ у детей с ОМЛ в первой ремиссии является выявление соотношения антилейкозного эффекта, увеличения уровня выживаемости больных с дальнейшим приемлемым качеством жизни.
В настоящее время кандидатами для алло-ТКМ являются пациенты высокой группы риска, имеющие HLA-идентичного донора костного мозга. Проблема аутологичной ТКМ (ауто-ТКМ) или периферических стволовых клеток (ПСК) в настоящее время изучается. В НИИ детской онкологии и гематологии РОНЦ им. Н.Н.Блохина РАМН разработаны протоколы лечения больных, использующие ауто-ТКМ и ПСК у больных ОМЛ с высокой группой риска в первой ремиссии и при рецидивах заболевания. Уже на сегодняшний день получены обнадеживающие результаты лечения.
В связи с тем что ОМЛ представлен группой неоднородных заболеваний, основным планом оптимизации лечения является индивидуализация терапии, дополненная предупреждением риска развития рецидивов, знаниями о биологии отдельных подвариантах ОМЛ.
Новыми препаратами, введенными в лечебные протоколы ОМЛ у детей в последнее десятилетие, являются 2-хлордеоксиаденозин (2-CDA) и флюдарабин. Применение в терапии новых агентов, включая иммунотерапию интерлейкином-2, лимфокинактивированными киллерами (LAK), генерированных из мононуклеарных клеток периферической крови, позволяет надеяться на значительные успехи в лечении ОМЛ в будущем.
В отделении химиотерапии лейкозов НИИ детской онкологии и гематологии, организованном 25 лет назад, проведено лечение 200 больным ОМЛ в возрасте от 1,5 месяца до 16 лет. За последние 10 лет благодаря применению новых подходов к лечению детей с ОМЛ с включением новых химиотерапевтических агентов и ТКМ удалось увеличить выживаемость больных до 50%, что в два раза превышает результаты терапии с использованием программы лечения “7+3” (цитозинарабинозид и рубомицин).
Благодаря внедрению в диагностику и программную терапию ОМЛ новых технологий удалось достичь значительного прогресса в результатах лечения рецидивов ОМЛ у детей.
Симптомы и лечение лейкоза у детей

- Главная
- Клиника
- Услуги
- Статьи
- Контакты
- Анализы
- Беременность и роды
- Беременность обзор
- Бесплодие и репродуктивный статус
- Бессонница и расстройства сна
- Болезни желудочно-кишечного тракта
- Болезни легких и органов дыхания
- Болезни органов кровообращения
- Болезни щитовидной железы
- Боль в спине
- Восстановительная медицина
- Генитальный герпес
- Гинекология
- Головная боль
- Грипп
- Депрессия
- Детская онкология
- Детские болезни
- Детское развитие
- Заболевания молочных желез
- Здоровое питание. Диеты
- Здоровье и душевное равновесие
- Из истории болезни
- Иммунология
- Импотенция (эректильная дисфункция)
- Инфекции передаваемые половым путем
- Кардиология
- Кровеносная и лимфатическая система
- Лейкемии
- Лечение рака
- Лимфогранулематоз
- Маммология
- Медицина в спорте
- Менопауза
- Микробиология, вирусология
- Педиатрия (детские болезни)
- Проблемная кожа
- Путь к себе
- Рак желудка
- Рак молочной железы (рак груди)
- Рак ободочной, прямой кишки и анального канала
- Рак предстательной железы (рак простаты)
- Рак тела матки
- Рак шейки матки
- Рак яичников
- Сахарный диабет
- Сексология и психотерапия
- Сексуальная жизнь
- Современная контрацепция
- Урология
- Уход за кожей
- Факты о здоровом старении
- Химиoтерапия
- Школа здоровья
- Эндокринология
| Острый лейкоз у детей. Симптомы. Диагностика. Принципы лечения. |
| Автор: http://www.eurolab.ua/ |
| 05 Мая 2011 |
|
Лейкозы наблюдают с частотой 4-5 случаев на 100 000 детей. В детском возрасте острый лейкоз диагностируют чаще, чем другие онкологические заболевания. Среди всех больных со злокачественными заболеваниями кроветворной и лимфоидной тканей каждый десятый больной – ребёнок. Пик заболеваемости лейкозом у детей приходится на возраст 2-4 года. В связи с наблюдаемой в последние десятилетия тенденцией к росту заболеваемости лейкозом и сохраняющейся высокой летальностью проблема лейкозов у детей стала особенно актуальной для практического здравоохранения. Этиология Причины возникновения лейкоза изучены не полностью. В настоящее время подтверждены этиологическая роль ионизирующего излучения, химических экзогенных факторов, онкогенных вирусов и значение наследственной предрасположенности к возникновению лейкоза. Сформулированы основные положения мутационной теории и клоновая концепция.
Патогенез Основные патогенетические звенья – изменение синтеза ДНК клеток, нарушение их дифференцировки и выход процесса из-под контроля регулирующих факторов. Общепризнанна моноклоновая теория развития гемобластозов, как и опухолей вообще. Согласно этой теории, лейкозные клетки представляют собой клон – потомство одной мутировавшей клетки. Клоновая теория патогенеза лейкоза рассматривает заболевание как результат пролиферации неконтролируемого клона клеток, утративших способность к дифференцировке и созреванию, постепенно замещающего другие ростки кроветворения. Известно, что мутации происходят почти непрерывно (в среднем в течение каждого часа мутирует одна клетка). У здоровых людей происходит элиминация изменённых клеток благодаря механизмам иммунной системы, реагирующей на эти клетки как на чужеродные. Следовательно, развитие лейкоза возможно при неблагоприятном сочетании воздействия мутагенных факторов и ослабления защитных сил организма. Патоморфология В основе лейкоза лежит гиперпластический опухолевый процесс в кроветворной ткани с очагами леикемическои метаплазии в различных органах и системах. Наиболее часто патологическое кроветворение возникает там, где оно существовало в эмбриональном периоде: в селезёнке, лимфатических узлах, печени. Изучение бластных клеток показало, что морфологический субстрат при остром лейкозе у разных больных неоднороден. По морфологии опухолевых клеток, а не по длительности болезни, лейкозы делят на острые и хронические. Клиническая картина Заболевание чаще начинается исподволь с появления неопределённых жалоб на боли в костях и суставах, утомляемость, снижение аппетита, нарушение сна, повышение температуры тела. Реже наблюдают внезапное начало заболевания с выраженной интоксикацией, геморрагическим синдромом.
В этом случае за счёт одутловатости лица дети внешне напоминают больных с эпидемическим паротитом.
В течении лейкоза выделяют три стадии (что необходимо для определения лечебной тактики).
Лабораторные исследования При остром лейкозе у детей в периферической крови обнаруживают властные клетки, анемию, тромбоцитопению, высокую СОЭ; количество лейкоцитов вариабельно: чаще выявляют лейкоцитоз различной степени, реже – лейкопению. Характерным диагностическим критерием служит «лейкемический провал (зияние)» (hiatus leucaemicus) – отсутствие промежуточных форм между бластными и зрелыми клетками. Исследование красного костного мозга обычно проводят после исследования периферической крови. Достоверный диагностический критерий острого лейкоза – обнаружение бластных клеток в стернальном пунктате в количестве более 30% клеточного состава красного костного мозга. Идентификацию варианта острого лейкоза проводят при исследовании пунктата красного костного мозга при помощи цитохимических маркерных реакций:
Выделение различных цитоморфологических форм заболевания имеет большое значение при выборе метода лечения. Диагностика Диагноз острого лейкоза ставят по клиническим данным (интоксикация, резкая бледность, полиадения и гепатоспленомегалия) и результатам исследования крови в динамике. Выявление в гемограмме бластных клеток с наличием «лейкемического зияния» позволяет заподозрить острый лейкоз. Подтверждают диагноз исследованием пунктата красного костного мозга. В тех редких случаях, когда исследование костного мозга не даёт чётких данных для диагностики, необходима трепанобиопсия. Обнаружение диффузной или крупноочаговой бластной инфильтрации в красном костном мозге при нарушении нормального соотношения ростков кроветворения помогает поставить диагноз. Для подтверждения диагноза нейролейкоза необходимо исследование ликвора. При этом обнаруживают ликворную гипертензию, плеоцитоз, непостоянное повышение содержания белка. Вспомогательным диагностическим методом служит исследование глазного дна. Нарастающий отёк дисков зрительного нерва свидетельствует о стойком повышении внутричерепного давления, связанном не только с отёком, но и в ряде случаев с лейкемоидной инфильтрацией головного мозга. При рентгенологическом исследовании черепа обнаруживают уплотнение костной ткани по ходу швов, усиление рисунка пальцевых вдавлений и сосудистого рисунка, остеопороз турецкого седла. Дифференциальная диагностика Дифференциальный диагноз лейкоза прежде всего проводят с лейкемоидной реакцией, возникающей в ответ на такие заболевания, как сепсис, тяжёлые формы туберкулёза, коклюш, опухоли и др. В этих случаях в периферической крови обнаруживают гиперлейкоцитоз, но в лейкограмме преобладают зрелые клетки и лишь изредка появляются единичные миелоциты, не бывает «лейкемического зияния». В пунктате красного костного мозга нет выраженного омоложения клеток. Изменения исчезают по мере выздоровления от основного заболевания. В дифференциальной диагностике острого лейкоза и агранулоцитоза, гипопластической анемии, тромбоцитопенической пурпуры, коллагеновых заболеваний, инфекционного мононуклеоза главными критериями должны быть результаты цитологического исследования красного костного мозга. Лечение Терапию острого лейкоза проводят только в специализированных гематологических клиниках. Задача современной терапии лейкоза – полная эрадикация (уничтожение) лейкозных клеток. Этого достигают путём использования современных, принципиально новых программ (протоколов) лечения острых лейкозов у детей, включающих применение цитостатиков, глюкокортикоидов, лучевой терапии, трансплантации гемопоэтических стволовых клеток, иммунотерапии. Можно выделить четыре основных направления терапии.
Этапы лечения: индукция (достижение) ремиссии, консолидация (закрепление) ремиссии, поддерживающая терапия. Задача своевременной терапии состоит не только в том, чтобы добиться ремиссии, но и в том, чтобы максимально её продлить и увеличить продолжительность жизни больного. Поскольку в период становления ремиссии в организме ребёнка сохраняется большое количество лейкозных клеток, необходима поддерживающая терапия. Однако ни интенсивная, ни поддерживающая терапия у большинства больных не в состоянии сдержать прогрессирование процесса, поэтому оправдана периодическая интенсификация лечения – реиндукция. В процессе разработки находится новый метод воздействия на лейкозный клон – иммунотерапия, заключающаяся в максимальной мобилизации иммунной системы организма больного с целью устранения иммунологической инертности организма по отношению к лейкозогенному агенту. Используют методы активной иммунотерапии, основанные на введении гуморальных иммунных факторов (плазмы, Ig), и методы адаптивной иммунотерапии, состоящей во введении в организм иммунокомпетентных клеток донора (введение иммунных лимфоцитов, трансплантация красного костного мозга). По характеру методы иммунотерапии могут быть и специфическими, когда для стимуляции иммунного ответа применяют другие антигены, например вакцину БЦЖ и противооспенную вакцину. Рациональные схемы иммунотерапии пока ещё находятся в стадии разработки. Успех лечения острого лейкоза зависит как от назначения специфической терапии, так и мероприятий по профилактике и терапии осложнений, обусловленных различными (преимущественно инфекционными) заболеваниями и побочными эффектами цитостатиков. В период лечения у больных возможны тошнота, рвота, анорексия. Самое грозное осложнение цитостатической терапии – угнетение костномозгового кроветворения, вследствие чего у больных развиваются такие инфекционные осложнения, как пневмония, энтеропатия, язвенно-некротический стоматит, гнойный отит и др. В этот период необходимо проводить интенсивную заместительную терапию, применять антибиотики широкого спектра действия и витамины. При глубокой миелодепрессии с целью профилактики инфекционных осложнений больного помещают в отдельную палату или бокс, где создают условия, максимально приближенные к стерильным. Персонал соблюдает те же правила асептики и антисептики, что и в операционных блоках. Лечение больных острым лейкозом представляет значительные трудности: оно всегда длительное, нередко чревато тяжёлыми осложнениями. В связи с этим лечение необходимо проводить в специализированных отделениях при полном взаимопонимании врача и родителей больного ребёнка. Достижения последних лет в лечении острого лейкоза позволяют существенно продлить жизнь ребёнка, а у отдельных больных – добиться полного выздоровления. Профилактика Первичная профилактика острого лейкоза не разработана. При достижении ремиссии необходима поддерживающая и противорецидивная терапия. Ребёнок подлежит наблюдению педиатра и онкогематолога. Необходим чёткий контроль за показателями крови. Не рекомендуют проводить физиотерапевтические процедуры и изменять климатические условия. Профилактические прививки проводят с учётом эпидемической ситуации по индивидуальному календарю. |

 Лейкоз – системное заболевание крови, характеризующееся замещением нормального костномозгового кроветворения пролиферацией менее дифференцированных и функционально активных клеток – ранних предшественников клеток лейкоцитарного ряда. Термин «лейкоз» предложил в 1921 г. Эллерман.
Лейкоз – системное заболевание крови, характеризующееся замещением нормального костномозгового кроветворения пролиферацией менее дифференцированных и функционально активных клеток – ранних предшественников клеток лейкоцитарного ряда. Термин «лейкоз» предложил в 1921 г. Эллерман.